Какво представлява Tolura?
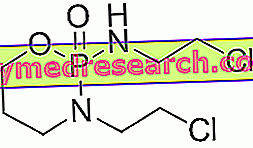
Tolura е лекарство, което съдържа активното вещество телмисартан. Предлага се под формата на бели таблетки (кръгли: 20 mg; овални: 40 mg; с форма на капсула: 80 mg).
Толура е "генерично лекарство". Това означава, че той е аналогичен на „референтното лекарство“, вече разрешено в Европейския съюз (ЕС), наречено Micardis.
За какво се използва Tolura?
Tolura е показан за лечение на есенциална хипертония (високо кръвно налягане) при възрастни. Терминът "съществен" означава, че хипертонията няма очевидна причина.
Лекарството се отпуска само по лекарско предписание.
Как се използва Tolura?
Препоръчваната доза Tolura е 40 mg веднъж дневно, но някои пациенти могат да се възползват от доза от 20 mg. Ако желаното кръвно налягане не бъде постигнато, можете да увеличите дозата до 80 mg или да добавите друго лекарство за хипертония, като хидрохлоротиазид.
Как действа Толура?
Активното вещество в Tolura, телмисартан, е "ангиотензин II рецепторен антагонист", т.е. блокира действието на хормон, произвеждан от организма, наречен ангиотензин II. Ангиотензин II е мощен вазоконстриктор (вещество, което стеснява кръвоносните съдове). Като блокира рецепторите, към които обикновено се свързва ангиотензин II, телмисартан предотвратява ефекта на хормона, като позволява на кръвоносните съдове да се разширяват. Това причинява спад в кръвното налягане и намалява рисковете, свързани с високо кръвно налягане, като например инфаркт или инсулт.
Какви проучвания са проведени на Tolura?
Тъй като Tolura е генерично лекарство, проучванията са ограничени до тестове, предназначени да покажат, че лекарството е биоеквивалентно на референтното лекарство Micardis. Две лекарства са биоеквивалентни, когато произвеждат същите нива на активното вещество в организма.
Какви са ползите и рисковете на Tolura?
Тъй като Tolura е генерично лекарство и биоеквивалент на референтното лекарство, ползите и рисковете от лекарството се считат за същите като референтното лекарство.
Защо е одобрен Tolura?
CHMP (Комитет за лекарствени продукти за хуманна употреба) заключи, че в съответствие с изискванията на ЕС е доказано, че Tolura има сравнимо качество и е биоеквивалентен на Micardis. Следователно становището на CHMP е, че както в случая с Micardis, ползите надвишават установените рискове. Поради това Комитетът препоръчва издаването на разрешение за пускане на пазара на Tolura.
Повече информация за Tolura
На 4 юни 2010 г. Европейската комисия издава на Krka dd, Novo Mesto разрешение за употреба, валидно за Tolura, валидно в целия Европейски съюз. Разрешението за употреба е валидно за срок от пет години, след което може да бъде подновено.
За пълната версия на EPAR на Tolura кликнете тук. За повече информация относно лечението с Tolura прочетете листовката (също част от EPAR) или попитайте Вашия лекар или фармацевт.
Пълният текст на EPAR относно референтното лекарство е също на уебсайта на Агенцията.
Последна актуализация на това резюме: 04-2010.