Протеините
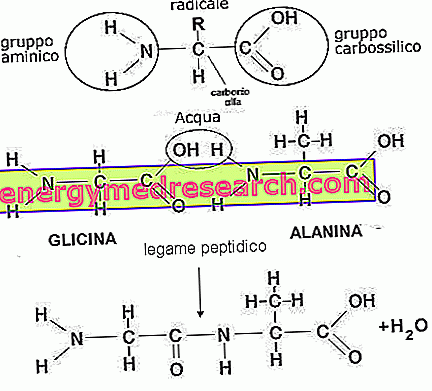
Протеините са полимерни молекули, съставени от повече от 100 аминокиселини, свързани с пептидни връзки (по-късите аминокиселинни вериги се наричат полипептиди или пептиди); структурата на протеините може да бъде повече или по-малко дълга, сгъната на себе си и фиксирана към други молекули (фактори, които определят нейната сложност и характеризират неговата биологична функция). Тези структури могат да бъдат класифицирани в: първична структура, вторична структура (α-спирала и β-лист), третична структура и кватернерна структура.

Функции на протеините
В природата протеините изпълняват много функции и най-известният със сигурност е структурният; Мислете само, че всяка тъканна матрица на нашето тяло се основава на скелет или полимерна мозайка, образувана от пептиди (напр. мускулни влакна, костна матрица, съединителна тъкан и от определена гледна точка дори кръв).
Не по-малко важна е функцията на биорегулиране и химическо / хормонално посредничество, всъщност протеините са основните съставки на ензимите и много хормони.
В кръвта протеините също играят важна транспортна функция; това е случаят с хемоглобин (транспорт на кислород), трансферин (транспорт на желязо), албумин (транспорт на липидни молекули) и др.
Все още в кръвоносния поток протеините се оказват полезни като имунна защита; те представляват ANTICORPI, есенциални молекули, произведени от лимфоцити, полезни в реакцията на организма срещу патогени.
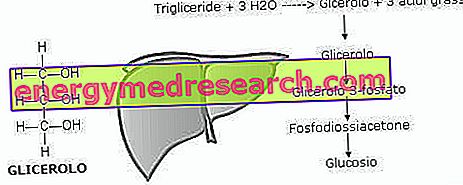
И накрая, протеините - по-точно аминокиселините - могат да се използват за енергийни цели чрез чернодробна неоглукогенеза и осигуряват 4 килокалории (ккал) на грам. Това е доста сложен процес, който чрез трансаминиране и деаминиране позволява на тялото да произвежда глюкоза в хипогликемични условия (възможно е предизвикано от гладно, особено интензивно и / или продължително мускулно усилие, патологични или неблагоприятни клинични състояния и т.н.). Някои неоглукогенни аминокиселини също могат да бъдат кетогенни, така че тяхното превръщане води до освобождаване на киселинни молекули, наречени кетонни тела.
NB. Енергийната функция на протеините трябва да бъде маргинална и подчинена на тази на захарите и мазнините.
Аминокиселини
Аминокиселините са кватернерни молекули, съставени от въглерод, водород, кислород и азот. Известни са повече от 500 вида и тяхната комбинация разграничава безбройни форми на пептиди. Обикновените, L-аминокиселини, са 20: аланин, аргинин, аспарагин, аспарагинова киселина, цистеин, глутаминова киселина, глутамин, глицин, хистидин, изолевцин, левцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирин и валина . От метаболизма на последното е възможно да се получи широк спектър от не-обикновени или случайни аминокиселини, които основно представляват хормони, ензими или междинни молекули (карнитин, хомоцистеин, креатин, таурин и др.).
Сред обикновените аминокиселини някои НЕ могат да бъдат синтезирани от тялото и се наричат ESSENTIAL; за възрастния мъж има 9: фенилаланин, левцин, изолевцин, лизин, метионин, треонин, триптофан и валин . При децата има общо 11; добавят се предишните: хистидин и аргинин .
Други класификации на аминокиселини са: на базата на полярността на техните странични вериги (неутрални неполярни, неутрални полярни, киселинни заряди, основни заряди) или на базата на вида на кореновата група (хидрофобни, хидрофилни, кисели, основни, ароматни).
Аминокиселини с разклонена верига
Сред съществените са и три аминокиселини, наречени разклонена верига (BCAA), съответно: левцин, изолевцин и валин ; особеността, която отличава аминокиселините с разклонена верига от другите, е представена от различен метаболитен път на производство на енергия.
Както вече беше обяснено, след трансаминиране-деаминиране, повечето аминокиселини могат да се използват за неоглукогенеза и да влязат в цикъла на Кребс под формата на оксалацетат или пируват . В крайна сметка, ако е имало истинска нужда, някои от аминокиселините, присъстващи в кръвния поток, ще влязат в чернодробните хепатоцити и ще излязат като глюкоза; за аминокиселини с разклонена верига не го прави. В сравнение с други, ВСАА са молекули, които директно могат да се използват от мускулите, и тази особеност ги прави много по-ефективни при директно производство на енергия и преобразуване за попълване на складовете на гликоген; от само себе си се разбира, че ако организмът е достатъчно хранен, катаболизмът на разклонените аминокиселини представлява почти неподходяща неоглукогенна част; глюкозата остава ВИНАГИ като първичен енергиен източник, следователно, в условията на резерви на кръвната захар и гликоген СЪЩО, дори при изпълнение на обикновени спортни резултати няма причина да се страхува, че мускулите се нуждаят от излишък от аминокиселини с разклонена верига.