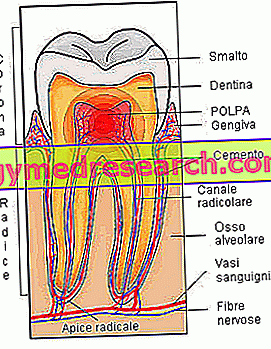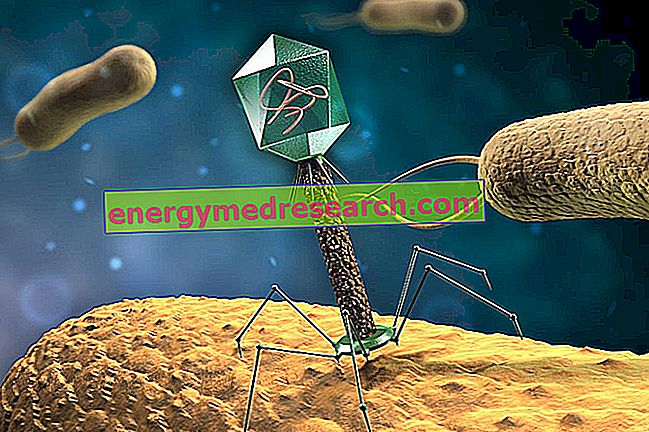
Бактериите също имат своите естествени врагове и много често капитулират пред атаката на много по-малки врагове от себе си, толкова микроскопични и прости, че дори не могат да се считат за живи организми. Говорим за някои вируси, наречени бактериофаги, които използват бактериални клетки за репликиране. Всъщност вирусът, за разлика от бактериите, не може да се счита за жив организъм, тъй като не може да се възпроизвежда самостоятелно; в този смисъл се казва, че вирусите са задължителни паразити, именно защото трябва да използват други клетки за възпроизвеждане.
Когато човешката клетка се експлоатира, вирусите създават определено увреждане на организма; обаче, когато патогенна бактериална клетка се експлоатира за хората, бактериофагите могат да станат съюзници на нашето здраве; и може да стане още повече в бъдеще, предвид нарастващия проблем с лекарствената резистентност и последващата бактериална нечувствителност към антибиотици.
Тези "естествени лекарства" също са особено икономични, тъй като фагите са най-многобройната биологична единица на Земята. Те също са много специфични, тъй като всеки бактериофаг действа решително върху бактериални видове или дори към специфични щамове; следователно, комбинацията от фаги, използвани за лечение на заболяване, трябва да бъде много специфична за отделния пациент, нещо като внимателно калибриран коктейл, след като се разбере кои бактерии причиняват заразата. Този хиперселективен подход, от една страна, усложнява терапевтичното използване на бактериофагите, но от друга страна позволява да се избегне убиването на добри бактерии, което е често срещан страничен ефект на традиционните антибиотични терапии с широк спектър на действие. Следователно, действието на фагите не разрушава комменсалната микрофлора на червата и по този начин се избягва появата на странични ефекти като диария и опортюнистични вторични инфекции.
Терапевтичното използване на бактериофагите се развива през първата половина на миналия век в бившия Съветски съюз, особено в Грузия, благодарение на изследването на Георгиос Елиава. На Запад научният интерес към терапията с фаги е намален от появата на антибиотици, но наскоро възстанови силата си поради подновения интерес към алтернативните терапии. FDA, например, е одобрила добавянето на специфични фаги за Salmonella и Escherichia Coli в различни хранителни продукти. В itticoltura фаги вече се използват днес като валидна алтернатива на употребата на антибиотици.
В допълнение към целия бактериофаг, могат да се използват и оръжията, с които тези вируси печелят бактериални защити, като лизини, способни да пробият бактериалната стена. Освен това, техниките на генното инженерство вече са създали "супер боб", способни да атакуват и да наемат повече бактериални видове.
По отношение на рисковете за здравето, ако терапията е добре калибрирана, те почти не съществуват. Всъщност човешкият организъм е особено свикнал да се занимава с фаги, които се срещат навсякъде, във всичко, което докосваме, ядем или пием. Освен това, разширяването на фагите в човешкия организъм зависи от степента на инфекциозната бактериална популация: тъй като това намалява поради същите фаги, дори вирусите намаляват концентрацията си. Това, inter alia, води до това, че след като веднъж се инжектира доза фаг в тялото, тези вируси се развиват бързо, увеличавайки неговата бактерицидна ефикасност с течение на времето (за разлика от антибиотиците, за които се изискват бустерни дози). Не само това, фактът, че фагите убиват клетъчните фрагменти, генериращи бактериални клетки, причинява тяхното действие за привеждане на човешката имунна система да действа с по-голяма интензивност; помислете например за фрагментите от LPS (липополизахарид) от разградената бактериална стена.
Потенциалните рискове за здравето разкриват възможното наличие на бактериални токсини в фаговия препарат и трансфера на бактериални гени между вирулентни щамове. Всъщност днес знаем, че фагите са отговорни за повечето заболявания, свързани с токсините; това е така, защото фагите в репликацията в бактериалната клетка произвеждат и / или освобождават токсините, които причиняват типичните симптоми на много заболявания; такъв е случаят например с коклюш, скарлатина и холера. Освен това, лизисът на някои бактериални видове може да доведе до освобождаване на големи количества ендотоксини, които отвъд определени граници преминават от стимулиране на имунната система към хипер-активиране, за да предизвикат токсичен шок поради огромното увеличение на производството на цитокини възпалително. Това препятствие може да бъде преодоляно чрез техниките на генното инженерство, с цел да се лишат бактериофагите от гените, необходими за синтеза на лизин; това също ограничава репликацията на фагите, тъй като вирусите без репликация вътре в бактериалната клетка не могат да избягат без лизин. Вторият проблем, от друга страна, е решен чрез избягване на използването на фагове на лизогенния цикъл, тъй като те, както вече споменахме, биха предпочели проблема с резистентността към антибиотик, вместо да го решат.