Трипсин и химотрипсин са два ключови ензима в храносмилането на хранителни протеини. И двете се произвеждат и секретират като зимогени, които са в неактивна форма, от панкреаса; зимогенният прекурсор на трипсина се нарича трипсиноген, докато химотрипсинът се нарича химотрипсиноген.
Трипсин и химотрипсин принадлежат към голямото семейство протеолитични ензими (участващи в разграждането на протеини) и в подгрупата на ендопептидаза. Тези вещества, включително стомашен пепсин и панкреатична еластаза, атакуват пептидните връзки в аминокиселинната верига, което води до по-малки молекулни фрагменти. Ензимите, принадлежащи към втората група, тези на екзопептидазите, завършват работата на трипсин и химотрипсин, като отделят отделни аминокиселини от краищата на пептидната верига; принадлежат към това семейство панкреатичните карбоксипептидази (А1, А2 и В, които атакуват карбоксилния край), но също така и аминопептидазите (които атакуват аминотерминалния край) и дипептидазите, произведени и секретирани от лигавицата на тънките черва. Някои карбоксипептидази, подобни на това, което се наблюдава при трипсин (трипсиногени) и химотрипсин (химотрипсиноген), се секретират от панкреаса в неактивна форма. И в трите случая ензимът, включен в процеса на ензимна активация, е ентеропептидаза, протеин, произведен и секретиран от дуоденалните лигавични клетки; по-специално, ентеропептидазата е специфична за трипсиноген, който след като се превръща в трипсин, също активира други протеолитични ензими, включително същия трипсиноген.
Функционалните различия между трипсин и химотрипсин просто се отнасят до тяхната специфичност, т.е. способността да разпознават и отделят само връзките, образувани от специфични аминокиселини. Трипсин се намесва главно в пептидни връзки, които задействат основни аминокиселини (като аргинин и лизин), докато химотрипсин предимно хидролизира връзки, включващи тирозин, фенилаланин, триптофан, левцин и метионин.
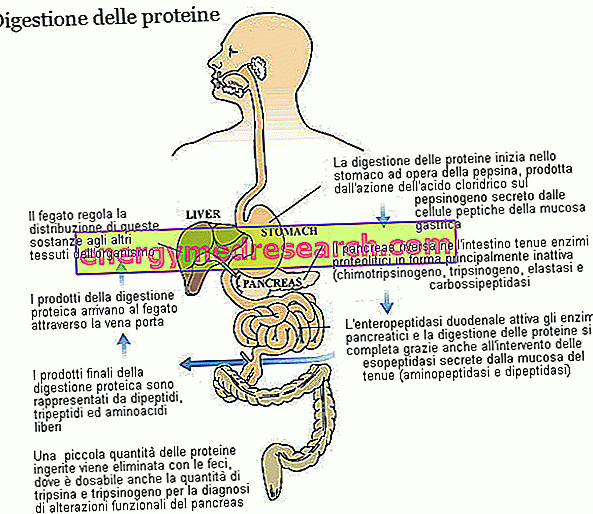
Благодарение на различните протеолитични ензими, с участието на стомашната киселинност, протеините от диетата - първоначално формирани от няколко десетки аминокиселини - се разграждат в дипептиди, трипептиди и свободни аминокиселини, всички лесно абсорбиращи се вещества, които от капилярите на чревната лигавица са транспортирани до черния дроб.
Трипсин и химотрипсин във фекалиите
Определянето на химотрипсин и трипсин в изпражненията се използва и е преди всичко в миналото като индиректен тест за функционалната способност на екзокринния панкреас. Ако нещо на нивото на тази жлеза не функционира правилно, логично е да се очаква намален синтез на трипсин и химотрипсин, които също ще имат дефицит във фекалиите. Тестът има добра чувствителност, но е обременен от реалния риск от фалшиви положителни и фалшиви негативи. Използването на лаксативи, например, намалява концентрацията на ензими в фекален материал, докато приемането на храносмилателни екстракти на панкреаса (като панкреатин) или зеленчуци (например стъблото на ананас, папая, папаин и бромелаин) са причина за фалшиво отрицателни резултати. Също така, чревната бактериална флора има слабо влияние върху количеството трипсин и химотрипсин, които достигат непроменено във фекалиите; поради тази причина използването на антибиотици може да доведе до фалшиви негативи; напротив, при наличието на дивертикулоза и други състояния, които благоприятстват бактериалната пролиферация, могат да бъдат регистрирани фалшиво положителни резултати.
Класическо приложение на трипсиновия и химотрипсиновия тест във фекалиите е откриването на панкреатична недостатъчност при пациенти с кистозна фиброза. Едно от последствията от това заболяване е увреждането на нормалния транспорт на трипсин и други храносмилателни ензими от панкреаса към дванадесетопръстника; поради тази причина, при раждането, фекалиите на детето, страдащо от кистозна фиброза, са особено компактни, до точката на предизвикване на чревна обструкция. В резултат се регистрират особено малки количества химотрипсин и трипсин в мекония.



